- 환자 중심의 안전관리 체계 확립을 통한
- 국민 건강 보호 길라잡이
 입니다.
입니다.
첨단바이오 정보동향 제132호
- 작성자 :
- 게시일 :
- 2024-12-12
- 조회수 :
- 618
▣ 국내
❍ 식약처, ‘첨단바이오의약품 분야 정책소통 간담회’개최 (’24.11.22.)
- 식품의약품안전처(이하 식약처)는 2024년 11월 22일, 첨단바이오의약품 관련 업계를 대상으로 첨단바이오의약품 미래발전 방향을 논의하기 위한 ‘첨단바이오의약품 분야 정책소통 간담회’를 개최함.
- 식약처는 첨단바이오의약품 규제과학센터, 관련 업계와 함께 업계와의 소통을 통해 의료 미래를 결정하는 첨단 기술이 첨단바이오의약품의 상용화로 나아갈 수 있도록 식약처의 규제적 지원 정책을 수립하고자 간담회를 마련함.
- 주요 내용은 ▲향후 첨단바이오의약품 정책 추진 방향, ▲장기추적조사 시스템 운영, 제조 및 품질관리(GMP)교육 등 첨단바이오의약품 안전관리 지원체계, ▲첨단바이오의약품 규제개선 방안 등이며, 관련하여 업계 의견을 수렴하였음.
https://www.mfds.go.kr/brd/m_99/view.do?seq=48694&srchFr=&srchTo=&srchWord=&srchTp=&itm_seq_1=0&itm_seq_2=0&multi_itm_seq=0&company_cd=&company_nm=&page=2
❍ 식약처, 첨단바이오의약품 장기추적조사 관련 민원인 안내서 2종 개정 (’24.11.28.)
- 식약처는 2024년 11월 28일, 첨단바이오의약품 장기추적조사계획에 포함되어야 하는 세부사항, 장기추적조사 대상 지정 해제 절차 및 방법 마련 등을 주요 내용으로 하는 ‘첨단바이오의약품 장기추적조사 관리기준(고시 제2024-47호, 2024.8.21.)’ 개정사항*을 반영하여 ‘첨단바이오의약품 장기추적조사 실시절차 가이드라인(민원인안내서)’ 및 ‘첨단바이오의약품 장기추적조사 이행·평가 결과보고 가이드라인(민원인 안내서)’를 개정함.
- 첨단바이오의약품 장기추적조사 실시절차 가이드라인(민원인안내서)은 첨단바이오의약품 투여 후 일정기간 동안 이상사례의 발생여부를 확인하기 위하여 임상시험 또는 품목허가 이후 장기추적조사를 수행할 때 장기추적조사 업무 절차 및 제출자료 등 필요한 사항을 제시(권고)하고 있음.
- 첨단바이오의약품 장기추적조사 이행·평가 결과보고 가이드라인(민원인 안내서)은 첨단바이오의약품 투여 후 일정기간 동안 이상사례의 발생여부를 확인하기 위한 장기추적조사를 이행하고, 이를 분석‧평가한 이행‧평가 결과보고를 작성·제출할 때 필요한 사항들을 예시를 통해 제시(권고)하고 있음.
- ‘첨단바이오의약품 장기추적조사 이행·평가 결과보고 가이드라인(민원인 안내서)’는 식약처 대표 누리집(mfds.go.kr>법령/자료>법령정보>공무원지침서/민원인안내서)에서 확인할 수 있음.
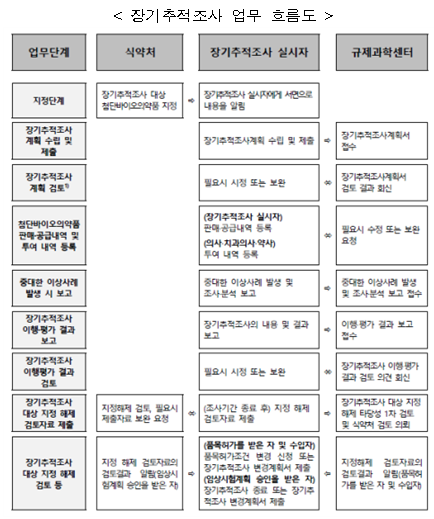
- ‘첨단바이오의약품 장기추적조사 실시 절차 가이드라인(민원인 안내서)’는 식약처 대표 누리집(mfds.go.kr>법령/자료>법령정보>공무원지침서/민원인안내서)에서 확인할 수 있음.
https://www.mfds.go.kr/brd/m_1060/view.do?seq=15559&srchFr=&srchTo=&srchWord=&srchTp=&itm_seq_1=0&itm_seq_2=0&multi_itm_seq=0&company_cd=&company_nm=&page=1
https://www.mfds.go.kr/brd/m_1060/view.do?seq=15560&srchFr=&srchTo=&srchWord=&srchTp=&itm_seq_1=0&itm_seq_2=0&multi_itm_seq=0&company_cd=&company_nm=&page=1
❍ 식약처, ‘유전자편집기술을 이용한 유전자치료제의 품질, 비임상 및 임상 평가 가이드라인(민원인 안내서)’개정 (’24.11.29.)
- 식약처는 2024년 11월 29일, 유전자편집기술을 이용한 유전자치료제의 품질, 비임상 및 임상 평가에서 고려해야 할 사항을 구체적으로 제시하기 위해 ‘유전자편집기술을 이용한 유전자치료제의 품질, 비임상 및 임상 평가 가이드라인(민원인 안내서)’를 개정함.
- 본 지침서는 기존 내용에 비임상 및 임상시험 시 고려사항과 표적 부위에서 일어난 유전자편집 양상에 대해 의도한 변이뿐만 아니라 의도하지 않은 변이를 포함한 표적 및 비표적 분석 시 고려사항 등 내용이 추가됨.
- 비임상시험에 대한 고려사항으로 ▲유전자편집 치료제의 비임상시험 목적, ▲유전자편집 치료제의 비임상시험 설계 시 고려사항, ▲특별 고려사항 등이 마련되었고, 임상시험에 대한 고려사항으로 ▲시험대상자, ▲용량 및 투여 일정, ▲치료 계획, ▲모니터링 및 추적 관찰, ▲평가변수, ▲소아 대상 연구의 특별 고려사항 등이 추가되었음.
- ‘유전자편집기술을 이용한 유전자치료제의 품질, 비임상 및 임상 평가 가이드라인(민원인 안내서)’는 식약처 대표 누리집(mfds.go.kr>법령/자료>법령정보>공무원지침서/민원인안내서)에서 확인할 수 있음.
▣ 미국
❍ FDA, Skysona(elivaldogene autotemcel) 투여 후 혈액학적 악성종양의 심각한 위험성 조사 (’24.11.27.)
- FDA(Food and Drug Administration, 이하 FDA)는 2024년 11월 27일, 초기의 활동성 대뇌부신백질형성장애(cerebral adrenoleukodystrophy, CALD)환자의 치료로 자가 조혈모세포(hematopoietic stem cell, HSC)기반 유전자치료제인 Skysona(elivaldogene autotemcel)*를 투여한 후 생명을 위협하는 골수형성이상증후군(myelodysplastic syndrome) 및 급성 골수성 백혈병(acute myeloid leukemia)을 포함한 혈액학적 악성종양 발생 사례 보고를 추가로 접수함. 보고된 혈액학적 악성종양 사례는 Skysona 치료와 관련된 것으로 보이며, 투여 후 14개월에서 92개월 사이에 임상시험 중에 진단된 것으로 나타남.
- FDA는 Skysona 투여 후 발생할 수 있는 중대한 혈액학적 악성종양 위험성을 조사하고 있으며 해당 위험에 따른 입원, 동종 조혈모세포 이식 필요, 사망과 같은 결과를 포함한 상황을 평가하고 추가적인 규제 조치가 필요한지 검토 중임. 이러한 혈액학적 악성종양 발생 위험성 때문에 의료진은 Skysona를 환자에게 투여하기 전에 인간 백혈구 항원(Human Leukocyte Antigen, HLA) 일치 기증자가 있는 경우 동종 조혈모세포 이식(allogeneic hematopoietic stem cell transplant)과 같은 대체 치료법을 신중히 고려해야함.
- 미국 내 Skysona 처방 정보(United States Prescribing Information, USPI)에는 치료 후 중대한 혈액학적 악성종양 발생 위험성이 박스 경고(Boxed Warning), 경고 및 주의사항(Warnings and Precautions), 임상시험 경험(Clinical Trials Experience) 항목에 포함되어 있음.
Skysona 치료를 받는 환자와 임상시험 참여자는 혈액학적 악성종양에 대해 평생 모니터링을 받아야 함. 이들은 혈액학적 악성종양의 조기 진단을 위해 최소 3개월마다 전혈구(complete blood count, CBC)검사를 실시하며, Skysona 투여 후 클론 확장(clonal expansion) 또는 우세성(predominance)을 평가하는 검사를 첫 해에는 최소 2회, 그 이후로는 매년 수행해야함. 임상적으로 필요한 경우 골수검사(bone marrow evaluations)를 고려할 수 있음. Skysona를 투여받은 환자에게 혈액학적 악성 종양이 발견되면 제조업체에 보고해야 하며, 추가 검사를 위해 샘플 수집에 대한 지침이 제공됨.
* Skysona 승인에는 연방 식품, 의약품 및 화장품법(Federal Food, Drug, and Cosmetic Act, FDCA) 505(o)조항에 따라 Skysona 치료 후 발생하는 장기적인 안전성과 2차 악성종양의 위험을 평가하기 위한 15년간의 장기추적조사, 전향적 안전성 연구를 포함하는 시판 후 요구사항(postmarketing requirement, PMR)을 가짐.
https://www.fda.gov/vaccines-blood-biologics/safety-availability-biologics/fda-investigating-serious-risk-hematologic-malignancy-following-skysona-elivaldogene-autotemcel
▣ 유럽
❍ EMA, PRAC(Pharmacovigilance Risk Assessment Committee) 11월 월간 회의 안건 공개 (’24.11.25.)
- 유럽의약품청(European Medicines Agency, EMA)은 2024년 11월 25일~28일에 진행된 약물감시위해평가위원회(PRAC) 11월 월간 회의 안건을 공개함.
https://www.ema.europa.eu/en/documents/agenda/agenda-prac-meeting-25-28-november-2024_en.pdf
❍ EMA, PRAC(Pharmacovigilance Risk Assessment Committee) 10월 월간 회의록 공개 (’24.11.27.)
- EMA는 2024년 9월 30일~10월 3일에 진행된 약물감시위해평가위원회(PRAC) 10월 월간 회의록을 공개함.
https://www.ema.europa.eu/en/documents/minutes/minutes-prac-meeting-30-september-03-october-2024_en.pdf
❍ EMA, CHMP(Committee for medicinal products for human use) 6월 월간 회의록 공개 (’24.11.28.)
- EMA는 2024년 6월 24일~27일에 진행한 약물사용자문위원회(CHMP) 6월 월간 회의록을 공개함.
https://www.ema.europa.eu/en/documents/minutes/minutes-chmp-meeting-24-27-june-2024_en.pdf
❍ EMA, CAT(Committee for Advanced Therapies) 10월 월간 회의록 공개 (’24.11.28.)
- EMA는 2024년 10월 9일~11일에 진행한 첨단치료위원회(CAT) 10월 월간 회의록을 공개함.
https://www.ema.europa.eu/en/documents/minutes/minutes-cat-meeting-9-11-october-2024_en.pdf
❍ EMA, PDCO(Paediatric Committee) 10월 월간 회의록 공개 (’24.12.2.)
- EMA는 2024년 10월 15일~18일에 진행한 소아위원회(PDCO) 10월 월간 회의록을 공개함.
https://www.ema.europa.eu/en/documents/minutes/minutes-pdco-minutes-15-18-october-2024-meeting_en.xlsx
❍ EMA, CAT(Committee for Advanced Therapies) 12월 월간 회의 안건 공개 (’24.12.2.)
- EMA는 2024년 12월 4일~6일에 진행한 첨단치료위원회(CAT) 12월 월간 회의 안건을 공개함.
https://www.ema.europa.eu/en/documents/agenda/agenda-cat-meeting-4-6-december-2024_en.pdf
❍ EMA, COMP(Committee for Orphan Medicinal Products) 12월 월간 회의 안건 공개 (’24.12.3.)
- EMA는 2024년 12월 3~5일에 진행한 희귀의약품위원회(COMP) 11월 월간 회의 안건을 공개함.
https://www.ema.europa.eu/en/documents/agenda/agenda-comp-meeting-3-5-december-2024_en.pdf
❍ EMA, 제3회 EU 혁신 네트워크(EU-IN) 다중 이해관계자 회의 자료 공개 (’24.12.3.)
- EU 혁신 네트워크(EU-Innovation network, EU-IN)와 이탈리아 의약품청(Italian Medicines Agency, AIFA)은 첨단치료의약품(Advanced Therapy Medicinal Products, ATMP) 개발 혁신을 효과적이고 안전한 의료 현장에서의 치료로 전환하기 위한 방안을 논의하기 위해 다자간 회의를 개최함. 2024년 11월 15일 개최된 회의에서는 모든 이해관계자에게 열린 포럼을 제공하고, 유럽 혁신 생태계(European Innovation Ecosystems) 전반에 걸친협력을 증진하는 것을 목표로 진행되었으며, 2024년 12월 3일 관련 회의 자료를 공개함.
v 일시: 2024년 11월 15일(금) 09:00–17:00 CET
v 주요 내용:
- 초기 개발 단계부터 시장 접근에 이르기까지 개발자들이 현재 직면하고 있는 주요 도전과제와 장벽에 대한 피드백 수집
- 유럽 및 국자 차원에서 혁신적 개발자를 위해 제공되는 과학적 및 규제적 자문 도구에 대한 통찰 제공
- 유럽 혁신 생태계 강화를 목표로 이해관계자 간의 상호 교류 및 협력을 촉진할 수 있는 기회에 대한 논의
https://www.ema.europa.eu/en/events/translating-innovation-access-atmps-third-eu-innovation-network-multi-stakeholder-meeting
❍ EPAR†(European Public Assessment Report) 업데이트 4건
†EPAR : EU의 CP(Centralised Procedure)로 허가된 제품에 대한 리뷰 리포트
* Sponsor 주소 및 Sponsorship 변경, ** Public Summary of opinion on orphan designation(희귀의약품 지정에 대한 의견 요약 발행 및 변경), *** 기타
∙ Abecma(idecabtagene vicleucel): 다발골수종 치료제
- 희귀의약품 지정일: ’17.4.20.
- 유럽 통합 허가일: ’21.8.18.
- 업데이트 사항(’24.11.27.): ***기타(제품 정보, 시판 후 절차 및 과학적 정보)
- 다발성 골수종(multiple myeloma): 골수에서 생성되는 백혈구의 일종인 형질세포의 분열이 통제되지 않아 비정상적이고 미성숙한 형질세포가 증식하여 발생함. 미성숙한 형질세포가 정상적인 백혈구, 적혈구, 혈소판 생성을 방해해 빈혈, 뼈 통증, 골절, 혈중 칼슘 수치 상승 및 신장질환과 같은 합병증이 발생함.
- 작용기전: 환자의 T세포를 채취 후 유전자 변형시켜 암세포에 특이적인 키메라 항원 수용체(chimeric antigen receptor, CAR) 단백질을 만들어, 변형된 CAR-T 세포를 환자에게 투여하면 골수종 표면의 B세포 성숙항원(B-cell maturation antigen)에 부착되어 암세포를 사멸함.
https://www.ema.europa.eu/en/medicines/human/EPAR/abecma
∙ Casgevy(exagamglogene autotemcel): β-지중해빈혈, 낫적혈구병 치료제
- 희귀의약품 지정일: (TDT) ’19.10.17., (SCD) ’20.1.9.
- 유럽 통합 허가일: ’24.2.9.
- 업데이트 사항(’24.12.3.): ***기타(제품 정보, 시판 후 절차 및 과학적 정보 업데이트)
- β-지중해빈혈(Beta-thalassaemia, TDT): 산소를 운반하는 적혈구의 단백질인 혈색소(haemoglobin)를 충분히 만들지 못하는 유전성 질환임. 혈색소의 구성 요소 중 하나인 베타글로빈(beta-globin)을 생산하는 유전자의 결함으로 인해 혈액 내 혈색소 수치가 낮아지며, 환자가 자주 수혈을 받아야 하는 중증 질환으로 심각한 빈혈 및 반복적인 수혈로 인한 합병증의 위험으로 생명을 위협할 수 있음.
- 낫적혈구병(sickle cell disease, SCD): 산소를 운반하는 적혈구 단백질인 혈색소 중 비정상적인 형태인 것이 존재하여 적혈구가 단단하고 끈적이며 디스크 모양에서 초승달 모양으로 변하는 유전성 질환임. 비정상적인 형태의 적혈구가 혈관 벽에 붙어 혈류를 방해하여 심장, 폐, 비장 등 내부 장기로 혈액 공급을 제한함. 반복적인 감염과 빈혈뿐만 아니라 장기에 심각한 통증과 손상을 일으키며, 생명을 위협할 수도 있는 중증 질환임.
- 작용기전: 자궁 내 태아에게 주로 발견되지만 성인에서도 소량 나타나는 혈색소의 일종인 태아혈색소(fetal haemoglobin, HbF)를 더 많이 생성할 수 있도록 줄기세포를 편집(CRISPR/Cas9 기술)한 치료제임. 태아혈색소(HbF)는 부족한 정상 성인 혈색소를 보완할 수 있기 때문에 환자에게 투여 시 β-지중해빈혈(TDT) 환자의 적혈구 수치를 높이고, 낫적혈구병(SCD) 환자의 고통스러운 위기를 예방할 수 있음.
https://www.ema.europa.eu/en/medicines/human/EPAR/casgevy
∙ Zolgensma(onasemnogene abeparvovec): 척수성 근위축증 치료제
- 희귀의약품 지정일: ’15.6.19.
- 유럽 통합 허가일: ’20.5.18.
- 업데이트 사항(’24.12.3.): ***기타(제품 정보, 시판 후 절차 및 과학적 정보 업데이트)
- 척수성 근위축증(spinal muscular atrophy, SMA): 보통 생후 1년에 진단되며, 운동 뉴런(근육의 움직임을 조절하는 뇌와 척수의 신경)에 영향을 미치는 SMN(survival motor neuron) 단백질이 SMN1 유전자의 돌연변이로 인해 생성되지 않아 발생하는 유전성 질환임. 운동 뉴런이 약화되어 근육 위축, 근력 약화 등의 증상이 나타나고 시간이 지남에 따라 호흡장애와 마비를 일으키기 때문에 장기간 쇠약해지고 생명을 위협하는 질환임.
- 작용기전: SMN 단백질의 유전자를 포함하도록 변형된 아데노부속바이러스(adeno-associated virus)로 제조된 의약품을 투여하면 해당 유전자를 신경세포로 전달하여 SMN 단백질 생산을 가능하게 함. 이를 통해 운동 뉴런의 생존과 기능을 개선하여 근육의 기능을 유지할 것으로 예상됨.
https://www.ema.europa.eu/en/medicines/human/EPAR/zolgensma
∙ Hemgenix(etranacogene dezaparvovec): B형 혈우병 치료제
- 희귀의약품 지정일: ’18.3.21.
- 유럽 통합 허가일: ’23.2.20.
- 업데이트 사항(’24.12.5.): ***기타(제품 정보, 시판 후 절차 및 과학적 정보 업데이트)
- B형 혈우병(Hemophilia B): 혈액 응고 과정에 관여하는 단백질 제IX인자가 부족하여 발생하는 유전성 출혈 질환임. 혈우병 B 환자는 정상인보다 출혈에 더 취약하며, 부상이나 수술 후 출혈이 오래 지속됨. 출혈은 팔꿈치, 무릎, 발목 등 관절의 공간이나 근육 내에서도 발생할 수 있으며, 반복적으로 발생할 경우 영구적인 손상을 초래할 수 있음. 또한, B형 혈우병은 뇌, 척수, 인후 또는 장에서 출혈이 발생할 수 있어 생명을 위협할 수 있음.
- 작용기전: Hemgenix의 활성 물질인 etranacogene dezaparvovec은 제IX인자를 생성하는 유전자 복제본을 포함하도록 변형된 바이러스를 기반으로 함. 환자에게 투여하면 변형된 바이러스가 간세포에 제IX인자 유전자를 전달하여 결핍된 제IX인자를 생산하고 출혈 에피소드(bleeding episode)를 막음. 또한, 이 약에 사용된 아데노부속바이러스(adeno-associated virus)는 인체 내에서 질병을 일으키지 않음.
https://www.ema.europa.eu/en/medicines/human/EPAR/hemgenix
❍ PIP(Paediatric Investigation Plan) 업데이트 3건
https://www.ema.europa.eu/en/medicines/human/paediatric-investigation-plans/emea-002168-pip01-17-m05
https://www.ema.europa.eu/en/medicines/human/paediatric-investigation-plans/emea-002776-pip01-20-m02
https://www.ema.europa.eu/en/medicines/human/paediatric-investigation-plans/emea-001995-pip01-16-m04
▣ 일본
❍ 식약처, ‘첨단바이오의약품 분야 정책소통 간담회’개최 (’24.11.22.)
- 식품의약품안전처(이하 식약처)는 2024년 11월 22일, 첨단바이오의약품 관련 업계를 대상으로 첨단바이오의약품 미래발전 방향을 논의하기 위한 ‘첨단바이오의약품 분야 정책소통 간담회’를 개최함.
- 식약처는 첨단바이오의약품 규제과학센터, 관련 업계와 함께 업계와의 소통을 통해 의료 미래를 결정하는 첨단 기술이 첨단바이오의약품의 상용화로 나아갈 수 있도록 식약처의 규제적 지원 정책을 수립하고자 간담회를 마련함.
- 주요 내용은 ▲향후 첨단바이오의약품 정책 추진 방향, ▲장기추적조사 시스템 운영, 제조 및 품질관리(GMP)교육 등 첨단바이오의약품 안전관리 지원체계, ▲첨단바이오의약품 규제개선 방안 등이며, 관련하여 업계 의견을 수렴하였음.
https://www.mfds.go.kr/brd/m_99/view.do?seq=48694&srchFr=&srchTo=&srchWord=&srchTp=&itm_seq_1=0&itm_seq_2=0&multi_itm_seq=0&company_cd=&company_nm=&page=2
❍ 식약처, 첨단바이오의약품 장기추적조사 관련 민원인 안내서 2종 개정 (’24.11.28.)
- 식약처는 2024년 11월 28일, 첨단바이오의약품 장기추적조사계획에 포함되어야 하는 세부사항, 장기추적조사 대상 지정 해제 절차 및 방법 마련 등을 주요 내용으로 하는 ‘첨단바이오의약품 장기추적조사 관리기준(고시 제2024-47호, 2024.8.21.)’ 개정사항*을 반영하여 ‘첨단바이오의약품 장기추적조사 실시절차 가이드라인(민원인안내서)’ 및 ‘첨단바이오의약품 장기추적조사 이행·평가 결과보고 가이드라인(민원인 안내서)’를 개정함.
- 첨단바이오의약품 장기추적조사 실시절차 가이드라인(민원인안내서)은 첨단바이오의약품 투여 후 일정기간 동안 이상사례의 발생여부를 확인하기 위하여 임상시험 또는 품목허가 이후 장기추적조사를 수행할 때 장기추적조사 업무 절차 및 제출자료 등 필요한 사항을 제시(권고)하고 있음.
- 첨단바이오의약품 장기추적조사 이행·평가 결과보고 가이드라인(민원인 안내서)은 첨단바이오의약품 투여 후 일정기간 동안 이상사례의 발생여부를 확인하기 위한 장기추적조사를 이행하고, 이를 분석‧평가한 이행‧평가 결과보고를 작성·제출할 때 필요한 사항들을 예시를 통해 제시(권고)하고 있음.
- ‘첨단바이오의약품 장기추적조사 이행·평가 결과보고 가이드라인(민원인 안내서)’는 식약처 대표 누리집(mfds.go.kr>법령/자료>법령정보>공무원지침서/민원인안내서)에서 확인할 수 있음.
- ‘첨단바이오의약품 장기추적조사 실시 절차 가이드라인(민원인 안내서)’는 식약처 대표 누리집(mfds.go.kr>법령/자료>법령정보>공무원지침서/민원인안내서)에서 확인할 수 있음.
https://www.mfds.go.kr/brd/m_1060/view.do?seq=15559&srchFr=&srchTo=&srchWord=&srchTp=&itm_seq_1=0&itm_seq_2=0&multi_itm_seq=0&company_cd=&company_nm=&page=1
https://www.mfds.go.kr/brd/m_1060/view.do?seq=15560&srchFr=&srchTo=&srchWord=&srchTp=&itm_seq_1=0&itm_seq_2=0&multi_itm_seq=0&company_cd=&company_nm=&page=1
❍ 식약처, ‘유전자편집기술을 이용한 유전자치료제의 품질, 비임상 및 임상 평가 가이드라인(민원인 안내서)’개정 (’24.11.29.)
- 식약처는 2024년 11월 29일, 유전자편집기술을 이용한 유전자치료제의 품질, 비임상 및 임상 평가에서 고려해야 할 사항을 구체적으로 제시하기 위해 ‘유전자편집기술을 이용한 유전자치료제의 품질, 비임상 및 임상 평가 가이드라인(민원인 안내서)’를 개정함.
- 본 지침서는 기존 내용에 비임상 및 임상시험 시 고려사항과 표적 부위에서 일어난 유전자편집 양상에 대해 의도한 변이뿐만 아니라 의도하지 않은 변이를 포함한 표적 및 비표적 분석 시 고려사항 등 내용이 추가됨.
- 비임상시험에 대한 고려사항으로 ▲유전자편집 치료제의 비임상시험 목적, ▲유전자편집 치료제의 비임상시험 설계 시 고려사항, ▲특별 고려사항 등이 마련되었고, 임상시험에 대한 고려사항으로 ▲시험대상자, ▲용량 및 투여 일정, ▲치료 계획, ▲모니터링 및 추적 관찰, ▲평가변수, ▲소아 대상 연구의 특별 고려사항 등이 추가되었음.
- ‘유전자편집기술을 이용한 유전자치료제의 품질, 비임상 및 임상 평가 가이드라인(민원인 안내서)’는 식약처 대표 누리집(mfds.go.kr>법령/자료>법령정보>공무원지침서/민원인안내서)에서 확인할 수 있음.
▣ 미국
❍ FDA, Skysona(elivaldogene autotemcel) 투여 후 혈액학적 악성종양의 심각한 위험성 조사 (’24.11.27.)
- FDA(Food and Drug Administration, 이하 FDA)는 2024년 11월 27일, 초기의 활동성 대뇌부신백질형성장애(cerebral adrenoleukodystrophy, CALD)환자의 치료로 자가 조혈모세포(hematopoietic stem cell, HSC)기반 유전자치료제인 Skysona(elivaldogene autotemcel)*를 투여한 후 생명을 위협하는 골수형성이상증후군(myelodysplastic syndrome) 및 급성 골수성 백혈병(acute myeloid leukemia)을 포함한 혈액학적 악성종양 발생 사례 보고를 추가로 접수함. 보고된 혈액학적 악성종양 사례는 Skysona 치료와 관련된 것으로 보이며, 투여 후 14개월에서 92개월 사이에 임상시험 중에 진단된 것으로 나타남.
- FDA는 Skysona 투여 후 발생할 수 있는 중대한 혈액학적 악성종양 위험성을 조사하고 있으며 해당 위험에 따른 입원, 동종 조혈모세포 이식 필요, 사망과 같은 결과를 포함한 상황을 평가하고 추가적인 규제 조치가 필요한지 검토 중임. 이러한 혈액학적 악성종양 발생 위험성 때문에 의료진은 Skysona를 환자에게 투여하기 전에 인간 백혈구 항원(Human Leukocyte Antigen, HLA) 일치 기증자가 있는 경우 동종 조혈모세포 이식(allogeneic hematopoietic stem cell transplant)과 같은 대체 치료법을 신중히 고려해야함.
- 미국 내 Skysona 처방 정보(United States Prescribing Information, USPI)에는 치료 후 중대한 혈액학적 악성종양 발생 위험성이 박스 경고(Boxed Warning), 경고 및 주의사항(Warnings and Precautions), 임상시험 경험(Clinical Trials Experience) 항목에 포함되어 있음.
Skysona 치료를 받는 환자와 임상시험 참여자는 혈액학적 악성종양에 대해 평생 모니터링을 받아야 함. 이들은 혈액학적 악성종양의 조기 진단을 위해 최소 3개월마다 전혈구(complete blood count, CBC)검사를 실시하며, Skysona 투여 후 클론 확장(clonal expansion) 또는 우세성(predominance)을 평가하는 검사를 첫 해에는 최소 2회, 그 이후로는 매년 수행해야함. 임상적으로 필요한 경우 골수검사(bone marrow evaluations)를 고려할 수 있음. Skysona를 투여받은 환자에게 혈액학적 악성 종양이 발견되면 제조업체에 보고해야 하며, 추가 검사를 위해 샘플 수집에 대한 지침이 제공됨.
* Skysona 승인에는 연방 식품, 의약품 및 화장품법(Federal Food, Drug, and Cosmetic Act, FDCA) 505(o)조항에 따라 Skysona 치료 후 발생하는 장기적인 안전성과 2차 악성종양의 위험을 평가하기 위한 15년간의 장기추적조사, 전향적 안전성 연구를 포함하는 시판 후 요구사항(postmarketing requirement, PMR)을 가짐.
https://www.fda.gov/vaccines-blood-biologics/safety-availability-biologics/fda-investigating-serious-risk-hematologic-malignancy-following-skysona-elivaldogene-autotemcel
▣ 유럽
❍ EMA, PRAC(Pharmacovigilance Risk Assessment Committee) 11월 월간 회의 안건 공개 (’24.11.25.)
- 유럽의약품청(European Medicines Agency, EMA)은 2024년 11월 25일~28일에 진행된 약물감시위해평가위원회(PRAC) 11월 월간 회의 안건을 공개함.
| ∙ Section 5. 위해성관리계획(Risk management plans (RMPs)) 5.1. 시판 전 단계의 의약품(Medicines in the pre-authorisation phase) - Lifileucel: PRAC RMP AR, PRAC RMP 평가 개요 및 첨단치료위원회(Committee for Advanced Therapies, CAT), 약물사용자문위원회(Committee for medicinal products for human use, CHMP)에 대한 조언 안건을 채택함. 5.3. 시판 후 단계의 의약품 – CHMP 주도 절차(Medicines in the post-authorisation phase – CHMP-led procedures) - ALOFISEL(Darvadstrocel): (4건의 Type II 변화 신청서)* PRAC RMP AR, PRAC RMP 평가 개요 및 CAT, CHMP에 대한 조언 안건을 채택함. * ① C.I.4(1건)-2개의 임상 3상 연구(ADMIRE-CD&ADAME-CD II)의 취합된 안전성 데이터를 기반으로 안전성 정보를 업데이트하고, 부속서 II에 의무사항으로 명시된 연구 ADAME-CD II의 최종 결과를 기반으로 효능 정보를 업데이트하기 위해 제품특성요약서(Summary of product characteristics, SmPC) section 4.8, 5.1 업데이트 및 부속서 II도 갱신함. ADAME-CD II(Cx601-0303)는 크론병 환자의 복합 항문주위 누공 치료를 위한 성인 동종 확장 지방 유래 줄기세포인 Cx601의 효능과 안전성을 평가하기 위한 임상 3상 연구로, 무작위 배정, 이중맹검, 위약대조군 연구임. 또한 품목허가권자(marketing authorisation holder, MAH)는 SmPC section 4.2 및 패키지 리플릿을 포함하여 제품 정보(Product information)에 편집 변경사항을 소개할 기회를 가짐. ② C.I.13(3건)-이용 가능한 모든 새로운 임상 데이터를 기반으로 Alofisel의 유익성-위해성 평가를 뒷받침하기 위한 연구 Darvadstrocel-3003 및 Alofisel-5003(INSPIRE)의 중간 결과 및 연구 Darvadstrocel-3002의 최종 결과를 제출함. 또한 RMP 버전 8.0도 제출함. ∙ Section 6. 정기적인 최신 안전성정보 보고서 (Periodic safety update reports (PSURs)) 6.1. PSUR 단일 평가 절차 (PSUR single assessment (PSUSA) procedures including centrally authorised products (CAPs) only) - CASGEVY(Exagamglogene autotemcel): CAT, CHMP 권고사항을 채택함. ∙ Section 7. 시판 후 안전성 연구 (Post-authorisation safety studies (PASS)) 7.1 시판 허가에 부과된 PASS 프로토콜(Protocols of PASS imposed in the marketing authorisation(s)) - EBVALLO(Tabelecleucel: (유럽의 실제 환경에서 엡스타인-바 바이러스 양성(EBV+) 이식 후 림프 증식성 질환(Post-transplant lymphoproliferative disorder, PTLD) 환자에서 Tabelecleucel의 안전성과 효과를 설명하기 위한 관찰 후 승인 안전성 연구(PASS)의 실질적인 수정 [PSA/S/0115에 대한 MAH의 반응]) PRAC 평가 보고서, PRAC 결과 서한을 채택함. 7.4 시판 허가에 부과되지 않은 PASS 결과(Results of PASS non-imposed in the marketing authorisation(s)) - TECARTUS(Brexucabtagene autoleucel): (RMP에 카테고리 3 연구로 기재된 비중재적 연구 KT-EU-4725966(TECARTUS 위해성 완화 조치에 대한 의료 전문 지식의 정량적 평가)에 대한 최종 연구 보고서 제출) PRAC 평가 보고서를 채택함. 7.5. 개정된 변동 규정 시행 전에 제출된 부과 및 미부과 PASS의 중간 결과(Interim results of imposed and non-imposed PASS submitted before the entry into force of the revised variation regulation) - CARVYKTI(Ciltacabtagene autoleucel): (초기 품목 허가 신청(Marketing Authorization Application, MAA) PASS 연구 68284528MMY4004)* CHMP에 대한 조언 안건을 채택함. * Ciltacabtagene Autoleucel로 치료한 다발골수종 환자의 안전성 평가를 위한 시판 후 안전성 연구의 두 번째 중간보고서 ∙ Section 18. 시판 허가 갱신, 조건부 갱신 및 연간 재평가(Renewals of the marketing authorisation, conditional renewals and annual reassessments) 8.1 시판 허가에 대한 연간 재평가(Annual reassessments of the marketing authorisation) - UPSTAZA(Eladocagene exuparvovec): (시판 허가에 대한 연간 재평가) CAT 및 CHMP에 대한 조언 안건을 채택함. 8.2 시판 허가에 대한 조건부 갱신(Conditional renewals of the marketing authorisation) - CASGEVY(Exagamglogene autotemcel): (시판 허가에 대한 조건부 갱신) CAT 및 CHMP 조언 안건을 채택함. |
https://www.ema.europa.eu/en/documents/agenda/agenda-prac-meeting-25-28-november-2024_en.pdf
❍ EMA, PRAC(Pharmacovigilance Risk Assessment Committee) 10월 월간 회의록 공개 (’24.11.27.)
- EMA는 2024년 9월 30일~10월 3일에 진행된 약물감시위해평가위원회(PRAC) 10월 월간 회의록을 공개함.
| ∙ Section 5. 위해성관리계획(Risk management plans (RMPs)) 5.1. 시판 전 단계의 의약품(Medicines in the pre-authorisation phase) - Beremagene geperpavec: (180일 전 단계: 태어날 때부터 제VII형 콜라겐 알파 1번 사슬(COL7A1) 유전자에 돌연변이가 있는 이영양성 수포성 표피박리증(dystrophic epidermolysis bullosa) 치료) - Delandistrogene moxeparvovec: (120일 전 단계: 3~7세의 보행 가능한 환자의 뒤쉔근디스트로피(Duchenne muscular dystrophy) 외래 환자 치료) - Dorocubicel(Allogeneic umbilical cord-derived CD34- cells, non-expanded): (신속 심사: 혈액학적 악성 종양(haematological malignancies) 성인 환자 치료) ∙ Section 15. 부속서 I - 위해성관리계획(Annex I- Risk management plans) 15.3. 시판 후 단계의 의약품 – CHMP 주도 절차(Medicines in the post-authorisation phase – CHMP-led procedures) - Axicabtagene ciloleucel(YESCARTA): (2건의 Type II 변경 신청서)* * ① C.I.13 - RMP에 category 3 연구로 기재된 KTE-C19-101(ZUMA-1) 연구의 최종 보고서를 제출함. KTE-C19-101은 불응성 공격성 비호지킨 림프종 피험자를 대상으로 Kte-C19의 안전성과 효능을 평가하는 임상 1/2상 다기관 연구임. ② C.I.13 - RMP에 category 3 연구로 기재된 KTE-C19-106(ZUMA-6) 연구의 최종 보고서를 제출함. KTE-C19-106은 불응성 미만성 거대 B세포 림프종(diffuse large B-cell lymphoma) 피험자를 대상으로 Kte-C19와 Atezolizumab을 병용하여 안전성과 효능을 평가하는 임상 1-2상 다기관 연구임. 또한 RMP 버전 9.2도 제출함. ∙ Section 16. 부속서 I – 정기적인 최신 안전성정보 보고서(Annex I - Periodic safety update reports (PSURs)) 16.1. EU 허가 의약품의 PSUR 단일 평가 절차(PSUR single assessment (PSUSA) procedures including centrally authorised products (CAPs) only) - Ciltacabtagene autoleucel(CARVYKTI): (PSUSA 절차 평가) - Ex vivo expanded autologous human corneal epithelial cells containing stem cells(HOLOCLAR): (PSUSA 절차 평가) - Valoctocogene roxaparvovec(ROCTAVIAN): (PSUSA 절차 평가) ∙ Section 18. 부속서 I - 시판 허가 갱신, 조건부 갱신 및 연간 재평가(Annex I – Renewals of the marketing authorisation, conditional renewals and annual reassessments) 18.2 시판 허가에 대한 연간 재평가(Annual reassessments of the marketing authorisation) - Etranacogene dezaparvovec(HEMGENIX): (시판 허가에 대한 조건부 갱신) - Exagamglogene autotemcel(CASGEVY): (시판 허가에 대한 조건부 갱신) |
https://www.ema.europa.eu/en/documents/minutes/minutes-prac-meeting-30-september-03-october-2024_en.pdf
❍ EMA, CHMP(Committee for medicinal products for human use) 6월 월간 회의록 공개 (’24.11.28.)
- EMA는 2024년 6월 24일~27일에 진행한 약물사용자문위원회(CHMP) 6월 월간 회의록을 공개함.
| ∙ Section 3. 최초 신청 단계(Initial applications) 3.4. 유럽 통합 절차를 위한 진행 중인 초기 신청서 업데이트(Update on on-going initial applications for Centralised procedure) - Autologous cartilage-derived articular chondrocytes, in-vitro expanded: (2024년 4월 채택된 질문 목록에 응답하기 위해 clock stop*을 연장 요청하는 신청인의 서한, CAT는 2024년 4월 19일에 채택된 질문 목록에 응답하기 위해 신청인의 clock stop 연장 요청에 동의함.) 2024년 4월 19일 채택된 질문 목록 관련 정보를 논의함. CHMP는 CAT가 채택한 일정표를 확인하고, 2024년 4월에 채택된 질문 목록에 응답하기 위해 신청자의 Clock stop 연장 요청을 승인함. * Clock stop: 의약품 평가가 중단되는 기간 |
https://www.ema.europa.eu/en/documents/minutes/minutes-chmp-meeting-24-27-june-2024_en.pdf
❍ EMA, CAT(Committee for Advanced Therapies) 10월 월간 회의록 공개 (’24.11.28.)
- EMA는 2024년 10월 9일~11일에 진행한 첨단치료위원회(CAT) 10월 월간 회의록을 공개함.
| ∙ Session 2. 첨단치료의약품 평가 (Evaluation of ATMP) 2.3. 180일차 미해결 문제 목록(Day 180 list of outstanding issues) - Beremagene geperpavec: (180일차 미해결 이슈 목록) 2014년 3월 15일 채택된 질문목록을 채택함. 심사관은 질문 목록에 대한 답변의 평가 결과를 발표했으며, 미해결 문제 목록과, 검토 일정표를 채택함. 2.4. 120일차 질문 목록(Day 120 list of questions) - Delandistrogene moxeparvovec: (120일차 질문 목록) 심사관은 MAA에 대한 평가를 발표했으며, 미해결 이슈 목록과, 검토 일정표를 채택함. - Dorocubicel(Allogeneic umbilical cord-derived CD34- cells, non-expanded): (120일차 질문 목록)* 관련 사항을 채택함. * 심사관은 MAA에 대한 평가를 발표했으며, CAT는 표준 평가 일정을 되돌리기로 결정함. 2.6. 최초 신청 단계 중 갱신 사항(Update on ongoing initial applications) - Autologous cartilage-derived articular chondrocytes, in-vitro expanded: CAT는 2024년 6월에 Clock stop 연장을 승인했으며, 신청자는 추가적인 Clock stop 요청에 대한 정당성을 제시함. 또한 CAT는 향후 Clock stop 규칙이 더욱 엄격하게 적용될 것이라고 언급했으나, 제출된 정당성에 근거하여 해당 Clock stop 연장을 허가하기로 한 심사관들의 입장에 동의함. 2.11. TYPEⅡ 변경과 (EC) No 1234/2008에 따른 치료적 적응증의 변화(Type II variations and variations of therapeutic indication procedure according to Commission Regulation(EC) No 1234/2008) - Kymriah(Tisagenlecleucel): (안전성, 의견)* 심사관은 평가 결과를 발표했으며, 보충 정보 요청을 채택함. * ① C.I.4: 문헌에 근거하여 사이토카인 방출 증후군에 대한 기존 경고를 수정하기 위해 SmPC section 4.4를 업데이트함. ② C.I.4: 문헌을 기반으로 신경학적 이상반응에 대한 기존 경고를 수정하기 위해 SmPC section 4.4를 업데이트하였으며, 그에 따라 패키지 리플릿이 업데이트됨. ③ C.I.4: 시판 후 데이터 및 문헌을 기반으로 과민반응에 대한 기존 경고를 수정하기 위해 SmPC section 4.4를 업데이트하고, 그에 따라 패키지 리플릿이 업데이트됨. 또한 MAH는 패키지 리플릿의 국가별 담당자 목록을 업데이트하고 제품 정보에 대한 편집 변경할 기회를 가짐. - Upstaza(Eladocagene exuparvovec): (품질, 보충 정보 요청) 심사관은 평가 결과를 제출했으며, 보충 정보 요청을 채택함. - Yescarta(Axicabtagene ciloleucel): (임상, 의견)* 2024년 6월 21일 채택된 보충 정보 요청을 채택함. 보고관은 평가 결과를 제출했으며, 보충 정보 요청에 관한 모든 사항은 적절히 해결됨. * 2건의 Type II 변경 신청서: ① C.I.13 - RMP에 category 3 연구로 기재된 KTE-C19-101(ZUMA-1) 연구의 최종 보고서를 제출함. KTE-C19-101은 불응성 공격성 비호지킨 림프종 피험자를 대상으로 Kte-C19의 안전성과 효능을 평가하는 임상 1/2상 다기관 연구임. ② C.I.13 - RMP에 category 3 연구로 기재된 KTE-C19-106(ZUMA-6) 연구의 최종 보고서를 제출함. KTE-C19-106은 불응성 미만성 거대 B세포 림프종(diffuse large B-cell lymphoma) 피험자를 대상으로 Kte-C19와 Atezolizumab을 병용하여 안전성과 효능을 평가하는 임상 1-2상 다기관 연구임. 또한 RMP 버전 11.0도 제출함. - Zolgensma(Onasemnogene abeparvovec): (임상, 보충 정보 요청)* 심사관은 평가 결과를 제출했으며, 보충 정보 요청을 채택함. * 절차 EMA/H/C/004750/P46/022에서의 요청과 연구 COAV101A12306의 데이터를 기반으로 SmPC section 5.1과 5.2를 업데이트하여 효능 및 벡터 배출(vector shedding) 데이터 정보를 갱신함. 또한, 절차 EMA/H/C/004750/P46/022의 최종 평가 보고서에 따라 section 4.4에 section 5.2에 대한 참조를 추가함. - Yescarta(Axicabtagene ciloleucel), Tecartus( Brexucabtagene autoleucel): (품질, 보충 정보 요청) 2024년 5월 24일, 2024년 2월 14일에 채택된 보충 정보요청을 채택함. 심사관은 평가 결과를 제출했으며, 세 번째 보충 정보 요청이 채택됨. 2.13. 기타 시판 후 활동(Other Post-Authorisation Activities) - Breyanzi(Lisocabtagene maraleucel): (임상, 의견)* 심사관은 평가 결과를 제출했으며, 보고서를 채택함. * 개정된 규정(EC) No1901/2006 제46조에 따라 제출된 소아 연구/ 임상 연구 보고서(Study No. JCAR017-BCM-004): 재발성/불응성 B세포 급성 림프구성 백혈병(B-cell acute Committee for Advanced Therapies (CAT) EMA/CAT/554433/2024 Page 9/25 lymphoblastic leukemia) 및 B세포 비호지킨 림프종(B-cell non-Hodgkin lymphoma)(Transcend PEDALL, BCM-004)을 앓고 있는 소아 환자를 대상으로 JCAR017의 안전성과 효능을 평가하기 위한 임상 2상, 오픈 라벨, 단일군, 다중 코호트, 다기관 임상시험. - Casgevy(Exagamglogene autotemcel): (시판 허가 갱신(1년)) 심사관은 Casgevy의 첫 번째 갱신에 대한 평가 결과를 제출했으며, 보충 정보 요청을 채택함. - Hemgenix(Etranacogene dezaparvovec): (시판 허가 갱신(1년)) 심사관은 Hemgenix의 갱신 평가 결과를 제출했으며, 구체적인 의무 사항 중 하나인 5년 추적조사 데이터 제출이 이행됨. 또한 갱신을 채택함. ∙ Session 4. 첨단치료의약품 분류에 대한 과학적 권고사항(Scientific Recommendation on Classification of ATMP) 4.1. 새로운 요청-CAT 코디네이터 임명(New requests – Appointment of CAT Coordinator) - Allogeneic CD19(4G7)CAR+_TCRαβ−_CD52+/− cells: (CAT 코디네이터 임명 및 일정표 채택) CAT 코디네이터 임명을 채택함. - Autologous adult bone marrow-derived, non-expanded CD133+ haematopoietic stem cells: (CAT 코디네이터 임명 및 일정표 채택) CAT 코디네이터 임명을 채택함. - Chimeric group B adenovirus from parental wildtype viruses Ad3 and Ad7 with attenuation in E3 region and no inserted sequences: (CAT 코디네이터 임명 및 일정표 채택) CAT 코디네이터 임명을 채택함. 4.2. 30일차 ATMP 과학적 권고사항(Day 30, ATMP scientific recommendation) - Human allogeneic cardiosphere-derived cells: (ATMP 과학적 권고사항) CAT는 분류 보고서에 대해 논의하였으며, CAT 사무국은 과학적 권고사항 초안을 유럽위원회(European Commission, EC)에 보내 2024년 10월 28일까지 의견을 요청함. - Allogenic fibroblasts embedded in a scaffold of hyaluronic acid and fibrinogen: (ATMP 과학적 권고사항) CAT는 분류 보고서에 대해 논의하였으며, CAT 사무국은 과학적 권고사항 초안을 EC에 보내 2024년 10월 28일까지 의견을 요청함. 4.3 60일차 개정된 과학적 권고사항(Day 60 revised scientific recommendation (following list of questions)) - hiPSC derived Ovarian Support Cells (OSCs): CAT는 수정된 과학 권고안에 대해 논의했으며, CAT 사무국은 과학적 권고사항 초안을 EC에 보내 2024년 10월 28일까지 의견을 요청함. 4.4. 마무리 과정(Finalisation of procedure) - Autologous cells mainly composed of CD45+CD3+ T cells and to minor extent of other cells like B cells and NK cells derived from the regional lymph node cells and enriched for neoantigen specific T cells: (EC 논평없음, ATMP 과학적 권고사항) 관련 분류 보고서를 채택함. 이 제품은 규정 (EC) No. 1394/2007의 제2(1)조에 규정된 체세포치료제의 정의를 충족함. - In vitro transcribed mRNA encoding the peptide VMAPRTLFL, a ligand for the activating immune receptor CD94/NKG2C: (EC 논평없음, ATMP 과학적 권고사항) 관련 분류 보고서를 채택함. 이 제품은 규정 (EC) No. 1394/2007의 제2(1)조에 규정된 유전자치료제의 정의를 충족함. - Recombinant adeno-associated virus vector containing an expression cassette of Padua factor IX transgene: (EC 논평없음, ATMP 과학적 권고사항) 관련 분류 보고서를 채택함. 이 제품은 규정 (EC) No. 1394/2007의 제2(1)조에 규정된 유전자치료제의 정의를 충족함. |
https://www.ema.europa.eu/en/documents/minutes/minutes-cat-meeting-9-11-october-2024_en.pdf
❍ EMA, PDCO(Paediatric Committee) 10월 월간 회의록 공개 (’24.12.2.)
- EMA는 2024년 10월 15일~18일에 진행한 소아위원회(PDCO) 10월 월간 회의록을 공개함.
| ∙ 규정 준수 점검(Compliance check) - Botaretigene sparoparvovec: 색소망막염(retinitis pigmentosa) 치료 관련 정보를 논의함. - Tabelecleucel: 엡스타인-바 바이러스 이식 후 림프세포증식질환(Epstein-Barr virus associated post-transplant lymphoproliferative disorder) 치료 관련 정보를 논의함. - Letetresgene autoleucel: 연부조직육종(soft tissue sarcoma) 치료 관련 90일차 논의 함. - Bidridistrogene xeboparvovec: 지대 근디스트로피(limb-girdle muscular dystrophy) 치료 관련 90일차 논의 함. ∙ 초기 소아 임상연구계획(Initial Paediatric Investigation Plan) - Ex vivo fused normal allogeneic human myoblast with Autologous human myoblast derived from duchenne muscular dystrophy affected donor: 보행 가능한 환자의 뒤센근디스트로피(Duchenne muscular dystrophy) 치료 관련 변경 요청(request for modification, RfM) 논의함. - Autologous regulatory T lymphocytes CD3+ CD4+ CD25+ CD127- FoxP3+, ex-vivo expanded: 증상 전(3단계) 제1형 당뇨병(presymptomatic (stage 3) diabetes mellitus type 1) 예방 관련 변경 요청(RfM) 논의함. ∙ 소아 임상연구계획 변경(Modification of Paediatric Investigation Plan) - Tabelecleucel: 엡스타인-바 바이러스 이식 후 림프세포증식질환(Epstein-Barr virus associated post-transplant lymphoproliferative disorder) 치료 관련 논의함. - Ex-vivo-expanded autologous human keratinocytes containing epidermal stem cells transduced with a LAMB3-encoding retroviral vector: 수포성 표피박리증(epidermolysis bullosa) 치료 관련 논의함. ∙ 의약품-특이적 면제(Product Specific Waiver) - Zimislecel: 저혈당에 대한 인식이 저하되어 재발성 중증 저혈당이 발생하는 제1형 당뇨병(type 1 diabetes mellitus) 치료 관련 의견을 논의함. - Esepapogene zalarnarepvec: 인간유두종바이러스 16 양성 구강인두 편평세포암종(human papillomavirus (HPV) 16 positive oropharyngeal squamous cell carcinoma) 치료 관련 의견을 논의함. |
https://www.ema.europa.eu/en/documents/minutes/minutes-pdco-minutes-15-18-october-2024-meeting_en.xlsx
❍ EMA, CAT(Committee for Advanced Therapies) 12월 월간 회의 안건 공개 (’24.12.2.)
- EMA는 2024년 12월 4일~6일에 진행한 첨단치료위원회(CAT) 12월 월간 회의 안건을 공개함.
| ∙ Session 2. ATMP 평가(Evaluation of ATMPs) 2.2. 구두 설명(Oral explanations) - Beremagene geperpavec: (미해결 문제 목록) 2024년 10월 11일 채택된 미해결 문제 목록 및 2024년 3월 15일 채택된 질문 목록 관련 논의 안건을 채택함. 2.4. 120일차 질문 목록(Day 120 list of questions) - Lifileucel: (120일차 질문 목록) 관련 안건을 채택함. 2.11. TYPEⅡ 변경과 (EC) No 1234/2008에 따른 치료적 적응증의 변경(Type II variations and variations of therapeutic indication procedure according to Commission Regulation(EC) No 1234/2008) - Alofisel(Darvadstrocel): (안전성)* 2024년 7월 19일 채택된 보충 정보 요청 안건을 채택함. * ① C.I.4(1건)-2개의 임상 3상 연구(ADMIRE-CD&ADAME-CD II)의 취합된 안전성 데이터를 기반으로 안전성 정보를 업데이트하고, 부속서 II에 의무사항으로 명시된 연구 ADAME-CD II의 최종 결과를 기반으로 효능 정보를 업데이트하기 위해 SmPC section 4.8, 5.1 업데이트 및 부속서 II도 갱신함. ADAME-CD II(Cx601-0303)는 크론병 환자의 복합 항문주위 누공 치료를 위한 성인 동종 확장 지방 유래 줄기세포인 Cx601의 효능과 안전성을 평가하기 위한 임상 3상 연구로, 무작위 배정, 이중맹검, 위약대조군 연구임. 또한 MAH는 SmPC section 4.2 및 패키지 리플릿을 포함하여 PI에 편집 변경사항을 소개할 기회를 가짐. ② C.I.13(3건)-이용 가능한 모든 새로운 임상 데이터를 기반으로 Alofisel의 유익성-위해성 평가를 뒷받침하기 위한 연구 Darvadstrocel-3003 및 Alofisel-5003(INSPIRE)의 중간 결과 및 연구 Darvadstrocel-3002의 최종 결과를 제출함. 또한 RMP 버전 8.0도 제출함. - Casgevy(Exagamglogene autotemcel): (품질) 관련 안건을 채택함. - Ebvallo(Tabelecleucel): (품질) 2024년 11월 8일, 2024년 9월 13일 채택된 보충 정보 요청 안건을 채택함. - Hemgenix(Etranacogene dezaparvovec): (임상, 의견)* 2024년 11월 8일 채택된 보충 정보 요청 안건을 채택함. * 수정된 9-point anti-AAV5 중화항체(Neutralising Antibody) 분석을 반영하기 위해 SmPC의 section 4.4 및 5.1을 업데이트함. 또한, MAH는 PI에 대한 소규모 편집 변경사항을 적용하고, 패키지 리플릿에 있는 국가별 담당자 목록을 업데이트하며, PI를 QRD 버전 10.4에 맞게 제공하는 기회를 가짐. - Kymriah(Tisagenlecleucel): (안전성)* 2024년 10월 11일 채택된 보충 정보 요청 관련 안건을 채택함. * ① C.I.4: 문헌에 근거하여 사이토카인 방출 증후군에 대한 기존 경고를 수정하기 위해 SmPC section 4.4를 업데이트함. ② C.I.4: 문헌을 기반으로 신경학적 이상반응에 대한 기존 경고를 수정하기 위해 SmPC section 4.4를 업데이트하였으며, 그에 따라 패키지 리플릿이 업데이트됨. ③ C.I.4: 시판 후 데이터 및 문헌을 기반으로 과민반응에 대한 기존 경고를 수정하기 위해 SmPC section 4.4를 업데이트하고, 그에 따라 패키지 리플릿이 업데이트됨. 또한 MAH는 패키지 리플릿의 국가별 담당자 목록을 업데이트하고 PI에 대한 편집 변경할 기회를 가짐. - Tecartus(Brexucabtagene autoleucel): (임상, 참고 안전성 정보(Reference Safety Information, RSI))* 관련 안건을 채택함. * RMP에 카테고리 3 연구로 기재된 비중재적 연구 KT-EU-4725966(TECARTUS 위해성 완화 조치에 대한 의료 전문 지식의 정량적 평가)에 대한 최종 연구 보고서 제출(PRAC 주도 절차) - Upstaza(Eladocagene exuparvovec): (품질, 의견) 2024년 10월 11일 채택된 보충 정보 요청 관련 안건을 채택함. - Yescarta(Axicabtagene ciloleucel): (픔질, 의견) 2024년 7월 19일 채택된 보충 정보 요청 관련 안건을 채택함. - Zolgensma(Onasemnogene abeparvovec): (임상)* 2024년 10월 11일 채택된 보충 정보 요청 안건을 채택함. - Tecartus(Brexucabtagene autoleucel), Yescarta(Axicabtagene ciloleucel): • (품질, 의견) 2024년 10월 11일, 2024년 5월 24일, 2024년 2월 16일 채택된 보충 정보 요청 안건을 채택함. • (품질, 보충 정보 요청) 2024년 9월 13일 채택된 보충 정보 요청 안건을 채택함. * 절차 EMA/H/C/004750/P46/022에서의 요청과 연구 COAV101A12306의 데이터를 기반으로 SmPC section 5.1과 5.2를 업데이트하여 효능 및 벡터 배출(vector shedding) 데이터 정보를 갱신함. 또한, 절차 EMA/H/C/004750/P46/022의 최종 평가 보고서에 따라 section 4.4에 section 5.2에 대한 참조를 추가함. 2.13. 기타 시판 후 활동(Other Post-Authorisation Activities) - Breyanzi(Lisocabtagene maraleucel): (품질) 관련 안건을 채택함. - CARVYKTI(Ciltacabtagene autoleucel): (약물감시)* 관련 안건을 채택함. * 두 번째 중간 보고서 / PASS 연구 68284528MMY4004: ciltacabtagene autoleucel로 치료한 다발골수종 환자의 안전성 평가를 위한 시판 후 안전성 연구(초기 MAA에서 부터) - Casgevy(Exagamglogene autotemcel): (시판 허가 갱신(1년), 의견) 2024년 10월 11일 채택된 보충 정보 요청 관련 안건을 채택함. - Upstaza(Eladocagene exuparvovec): (연간 재평가) 관련 안건을 채택함. - Zolgensma(Onasemnogene abeparvovec): (비임상)* 관련 안건을 채택함. * ① 2024년 7월 채택된 LEG 024 [[PSUSA-00010848-202305: Study reports for 2170026 & 222018] RSI에 대한 대한 MAH의 응답 ② Study no. 2170026(OAV101: 최대 24주의 평가 기간을 갖는 신생아 FVB/NCrl 마우스의 단회 정맥 또는 뇌실 내 주사(Intracerebroventricular) 생식세포(Germline) 전이 및 통합 연구) ③ Study no. 2220183: 투여 28일 후 scAAV9-CB-GFP 및 scAAV9-CB-mCherry의 마카크 원숭이(Cynomolgus macaque) 생식선 조직에서 AAV 벡터 발현 ∙ Session 4. 첨단치료의약품 분류에 대한 과학적 권고사항(Scientific Recommendation on Classification of ATMP) 4.2. 30일째, ATMP 과학적 권고사항(Day 30 ATMP scientific recommendation) - Autologous primary urothelial cells expanded: (ATMP 과학적 권고사항) 관련 안건을 채택함. - Adeno-associated virus serotype 5 containing the human NR2E3 gene (AAV5hNR2E3): (ATMP 과학적 권고사항) 관련 안건을 채택함. - CD70 CAR+, TCRαβ− viable cells: (ATMP 과학적 권고사항) 관련 안건을 채택함. 4.4. 마무리 과정(Finalisation of procedure) - Allogeneic CD19(4G7)CAR+_TCRαβ−_CD52+/− cells: (EC 논평 없음, ATMP 과학적 권고사항) 관련 안건을 채택함. - Autologous adult bone marrow-derived, non-expanded CD133+ haematopoietic stem cells: (EC 논평 없음, ATMP 과학적 권고사항) 관련 안건을 채택함. - Chimeric group B adenovirus from parental wildtype viruses Ad3 and Ad7 with attenuation in E3 region and no inserted sequences: (EC 논평 없음, ATMP 과학적 권고사항) 관련 안건을 채택함. |
https://www.ema.europa.eu/en/documents/agenda/agenda-cat-meeting-4-6-december-2024_en.pdf
❍ EMA, COMP(Committee for Orphan Medicinal Products) 12월 월간 회의 안건 공개 (’24.12.3.)
- EMA는 2024년 12월 3~5일에 진행한 희귀의약품위원회(COMP) 11월 월간 회의 안건을 공개함.
| ∙ Section 4. 최초 시판 허가 당시 희귀의약품에 대한 희귀의약품 지정 검토(Review of orphan designation for orphan medicinal products at time of initial marketing authorisation) 4.2 CHMP 의견 채택 전 논의를 위한 희귀의약품 지정 제품(Orphan designated products for discussion prior to adoption of CHMP opinion) - beremagene geperpavec: 수포성 표피박리증(epidermolysis bullosa) 치료 관련 정보 안건을 채택함. |
https://www.ema.europa.eu/en/documents/agenda/agenda-comp-meeting-3-5-december-2024_en.pdf
❍ EMA, 제3회 EU 혁신 네트워크(EU-IN) 다중 이해관계자 회의 자료 공개 (’24.12.3.)
- EU 혁신 네트워크(EU-Innovation network, EU-IN)와 이탈리아 의약품청(Italian Medicines Agency, AIFA)은 첨단치료의약품(Advanced Therapy Medicinal Products, ATMP) 개발 혁신을 효과적이고 안전한 의료 현장에서의 치료로 전환하기 위한 방안을 논의하기 위해 다자간 회의를 개최함. 2024년 11월 15일 개최된 회의에서는 모든 이해관계자에게 열린 포럼을 제공하고, 유럽 혁신 생태계(European Innovation Ecosystems) 전반에 걸친협력을 증진하는 것을 목표로 진행되었으며, 2024년 12월 3일 관련 회의 자료를 공개함.
v 일시: 2024년 11월 15일(금) 09:00–17:00 CET
v 주요 내용:
- 초기 개발 단계부터 시장 접근에 이르기까지 개발자들이 현재 직면하고 있는 주요 도전과제와 장벽에 대한 피드백 수집
- 유럽 및 국자 차원에서 혁신적 개발자를 위해 제공되는 과학적 및 규제적 자문 도구에 대한 통찰 제공
- 유럽 혁신 생태계 강화를 목표로 이해관계자 간의 상호 교류 및 협력을 촉진할 수 있는 기회에 대한 논의
https://www.ema.europa.eu/en/events/translating-innovation-access-atmps-third-eu-innovation-network-multi-stakeholder-meeting
❍ EPAR†(European Public Assessment Report) 업데이트 4건
†EPAR : EU의 CP(Centralised Procedure)로 허가된 제품에 대한 리뷰 리포트
* Sponsor 주소 및 Sponsorship 변경, ** Public Summary of opinion on orphan designation(희귀의약품 지정에 대한 의견 요약 발행 및 변경), *** 기타
∙ Abecma(idecabtagene vicleucel): 다발골수종 치료제
- 희귀의약품 지정일: ’17.4.20.
- 유럽 통합 허가일: ’21.8.18.
- 업데이트 사항(’24.11.27.): ***기타(제품 정보, 시판 후 절차 및 과학적 정보)
- 다발성 골수종(multiple myeloma): 골수에서 생성되는 백혈구의 일종인 형질세포의 분열이 통제되지 않아 비정상적이고 미성숙한 형질세포가 증식하여 발생함. 미성숙한 형질세포가 정상적인 백혈구, 적혈구, 혈소판 생성을 방해해 빈혈, 뼈 통증, 골절, 혈중 칼슘 수치 상승 및 신장질환과 같은 합병증이 발생함.
- 작용기전: 환자의 T세포를 채취 후 유전자 변형시켜 암세포에 특이적인 키메라 항원 수용체(chimeric antigen receptor, CAR) 단백질을 만들어, 변형된 CAR-T 세포를 환자에게 투여하면 골수종 표면의 B세포 성숙항원(B-cell maturation antigen)에 부착되어 암세포를 사멸함.
https://www.ema.europa.eu/en/medicines/human/EPAR/abecma
∙ Casgevy(exagamglogene autotemcel): β-지중해빈혈, 낫적혈구병 치료제
- 희귀의약품 지정일: (TDT) ’19.10.17., (SCD) ’20.1.9.
- 유럽 통합 허가일: ’24.2.9.
- 업데이트 사항(’24.12.3.): ***기타(제품 정보, 시판 후 절차 및 과학적 정보 업데이트)
- β-지중해빈혈(Beta-thalassaemia, TDT): 산소를 운반하는 적혈구의 단백질인 혈색소(haemoglobin)를 충분히 만들지 못하는 유전성 질환임. 혈색소의 구성 요소 중 하나인 베타글로빈(beta-globin)을 생산하는 유전자의 결함으로 인해 혈액 내 혈색소 수치가 낮아지며, 환자가 자주 수혈을 받아야 하는 중증 질환으로 심각한 빈혈 및 반복적인 수혈로 인한 합병증의 위험으로 생명을 위협할 수 있음.
- 낫적혈구병(sickle cell disease, SCD): 산소를 운반하는 적혈구 단백질인 혈색소 중 비정상적인 형태인 것이 존재하여 적혈구가 단단하고 끈적이며 디스크 모양에서 초승달 모양으로 변하는 유전성 질환임. 비정상적인 형태의 적혈구가 혈관 벽에 붙어 혈류를 방해하여 심장, 폐, 비장 등 내부 장기로 혈액 공급을 제한함. 반복적인 감염과 빈혈뿐만 아니라 장기에 심각한 통증과 손상을 일으키며, 생명을 위협할 수도 있는 중증 질환임.
- 작용기전: 자궁 내 태아에게 주로 발견되지만 성인에서도 소량 나타나는 혈색소의 일종인 태아혈색소(fetal haemoglobin, HbF)를 더 많이 생성할 수 있도록 줄기세포를 편집(CRISPR/Cas9 기술)한 치료제임. 태아혈색소(HbF)는 부족한 정상 성인 혈색소를 보완할 수 있기 때문에 환자에게 투여 시 β-지중해빈혈(TDT) 환자의 적혈구 수치를 높이고, 낫적혈구병(SCD) 환자의 고통스러운 위기를 예방할 수 있음.
https://www.ema.europa.eu/en/medicines/human/EPAR/casgevy
∙ Zolgensma(onasemnogene abeparvovec): 척수성 근위축증 치료제
- 희귀의약품 지정일: ’15.6.19.
- 유럽 통합 허가일: ’20.5.18.
- 업데이트 사항(’24.12.3.): ***기타(제품 정보, 시판 후 절차 및 과학적 정보 업데이트)
- 척수성 근위축증(spinal muscular atrophy, SMA): 보통 생후 1년에 진단되며, 운동 뉴런(근육의 움직임을 조절하는 뇌와 척수의 신경)에 영향을 미치는 SMN(survival motor neuron) 단백질이 SMN1 유전자의 돌연변이로 인해 생성되지 않아 발생하는 유전성 질환임. 운동 뉴런이 약화되어 근육 위축, 근력 약화 등의 증상이 나타나고 시간이 지남에 따라 호흡장애와 마비를 일으키기 때문에 장기간 쇠약해지고 생명을 위협하는 질환임.
- 작용기전: SMN 단백질의 유전자를 포함하도록 변형된 아데노부속바이러스(adeno-associated virus)로 제조된 의약품을 투여하면 해당 유전자를 신경세포로 전달하여 SMN 단백질 생산을 가능하게 함. 이를 통해 운동 뉴런의 생존과 기능을 개선하여 근육의 기능을 유지할 것으로 예상됨.
https://www.ema.europa.eu/en/medicines/human/EPAR/zolgensma
∙ Hemgenix(etranacogene dezaparvovec): B형 혈우병 치료제
- 희귀의약품 지정일: ’18.3.21.
- 유럽 통합 허가일: ’23.2.20.
- 업데이트 사항(’24.12.5.): ***기타(제품 정보, 시판 후 절차 및 과학적 정보 업데이트)
- B형 혈우병(Hemophilia B): 혈액 응고 과정에 관여하는 단백질 제IX인자가 부족하여 발생하는 유전성 출혈 질환임. 혈우병 B 환자는 정상인보다 출혈에 더 취약하며, 부상이나 수술 후 출혈이 오래 지속됨. 출혈은 팔꿈치, 무릎, 발목 등 관절의 공간이나 근육 내에서도 발생할 수 있으며, 반복적으로 발생할 경우 영구적인 손상을 초래할 수 있음. 또한, B형 혈우병은 뇌, 척수, 인후 또는 장에서 출혈이 발생할 수 있어 생명을 위협할 수 있음.
- 작용기전: Hemgenix의 활성 물질인 etranacogene dezaparvovec은 제IX인자를 생성하는 유전자 복제본을 포함하도록 변형된 바이러스를 기반으로 함. 환자에게 투여하면 변형된 바이러스가 간세포에 제IX인자 유전자를 전달하여 결핍된 제IX인자를 생산하고 출혈 에피소드(bleeding episode)를 막음. 또한, 이 약에 사용된 아데노부속바이러스(adeno-associated virus)는 인체 내에서 질병을 일으키지 않음.
https://www.ema.europa.eu/en/medicines/human/EPAR/hemgenix
❍ PIP(Paediatric Investigation Plan) 업데이트 3건
| 성분명 | Onasemnogene abeparvovec |
| 치료분야 | 신경학 |
| 채택번호 | P/0412/2023 |
| PIP 번호 | EMEA-002168-PIP01-17-M05 |
| 약물형태 | 수액제, 주입용 분산액 |
| 적응증 | 척수성 근위축증(spinal muscular atrophy) |
| 개발사 | Novartis Gene Therapy EU Limited |
| 업데이트 사항 (’24.11.22.) |
P/0412/2023: 소아 임상시험 계획 수정 동의에 대한 EMA 결정(2023.10.27.) |
https://www.ema.europa.eu/en/medicines/human/paediatric-investigation-plans/emea-002168-pip01-17-m05
| 성분명 | Autologous tumour-infiltrating lymphocytes (LN-144/LN-145) |
| 치료분야 | 종양학 |
| 채택번호 | P/0440/2023 |
| PIP 번호 | EMEA-002776-PIP01-20-M02 |
| 약물형태 | 주입용 분산액 |
| 적응증 | 악성 종양 범주에 포함된 모든 질환(조혈 및 림프 조직 종양 제외)(all conditions included in the category of malignant neoplasms (except haematopoietic and lymphoid tissue neoplasms)) |
| 개발사 | Iovance Biotherapeutics, Inc. |
| 업데이트 사항 (’24.11.27.) |
P/0440/2023: 소아 임상시험 계획 수정 동의에 대한 EMA 결정(2024.10.27.) |
https://www.ema.europa.eu/en/medicines/human/paediatric-investigation-plans/emea-002776-pip01-20-m02
| 성분명 | Lisocabtagene maraleucel |
| 치료분야 | 종양학 |
| 채택번호 | P/0448/2023 |
| PIP 번호 | EMEA-001995-PIP01-16-M04 |
| 약물형태 | 주입용 분산액 |
| 적응증 | B-림프구성 백혈병/림프종(B-lymphoblastic leukaemia/lymphoma) 성숙 B-세포 종양(mature B-cell neoplasms) |
| 개발사 | Bristol-Myers Squibb Pharma EEIG |
| 업데이트 사항 (’24.11.28.) |
소아 임상시험 계획 수정 동의에 대한 EMA 결정(2023.10.27.) |
https://www.ema.europa.eu/en/medicines/human/paediatric-investigation-plans/emea-001995-pip01-16-m04
▣ 일본
❍ MHLW, 제4회 약사심의회 재생의료 등 제품·생물 유래 기술 분과위원회 개최 (’24.11.25.)
- 후생노동성(Ministry of Health, Labour and Welfare, MHLW)은 2024년 11월 25일 「제4회 약사심의회 재생의료 등 제품·생물유래기술분과위원회(第4回 薬事審議会 再生医療等製品・生物由来技術部会」의 개최를 안내함.
v 일시: 2024년 12월 9일(월), 16:00~18:00
v 장소: 웹 회의
v 비공개 안건:
• 심의사항:
- 재생의료 등 제품 'mRNA-3927'의 희귀질병용 재생의료 등 제품 지정 여부
- 재생의료 등 제품 'Avalotcagene ontaparvoec'의 희귀질병용 재생의료 등 제품 지정 여부
- 재생의료 등 제품 'nadofaragene firadenovec'의 희귀질병용 재생의료 등 제품 지정 여부
https://www.mhlw.go.jp/stf/newpage_45769.html
❍ PMDA Updates (2024년 11월호) 게재 (’24.11.28.)
- 의약품의료기기종합기구(Pharmaceuticals and Medical Devices Agency, PMDA)는 PMDA Updates 2024년 11월호를 통해 2024년 10 월 7 일 ‘제12회 일본-대만 의약 교류회의’ 개최 소식을 알림.
- 본 회의는 2013년 11월 5일에 공익 재단법인 교류 협회 및 아동 관계 협회 간에 체결된 "약사 규제 협력 골조에 관한 각서"를 근거로 2013년부터 매년 개최되고 있는 민관 협동의 심포지엄임. 이번 회의는 동아시아 지역에서의 의약품, 의료기기, 재생의료 등 제품의 접근성 향상을 위한 협력체제의 기반 구축의 일환으로 ▲의약품·의료기기·재생의료 등 제품의 규제에 관한 일본·대만의 최신 상황, ▲지속적인 의약품 공급을 향한 대처, ▲일본·대만의 의료보험제도의 최신 정보 등에 관한 강연·의견 교환을 목적으로 개최됨.
https://www.pmda.go.jp/int-activities/outline/0007.html
https://www.pmda.go.jp/files/000272145.pdf
❍ PMDA, 인도적 관점에서 실시되는 치험 정보 업데이트 (’24.11.29.)
- PMDA는 인도적 관점에서 실시되는 치험(확대 치험) 정보를 2024년 11월 29일자로 업데이트함.
- PMDA의 “人道的見地から実施される治験(인도적 관점에서 실시되는 치험)”은 일반적인 임상시험의 기준에 부합하지 않는 환자들에게도 새로운 치료법이나 의약품에 대한 접근을 가능할 수 있도록 도입된 특별한 제도(확대치험)(2016년 1월 22일자 약생심사발 0122 제7호, 2016년 7월 21일자 약생기심사발 0721 제1호)임. 이 제도는 환자의 삶의 질을 향상시키거나 생명을 연장시키는 것을 목표로 일반적 치험의 절차나 기준을 따르진 않으나, 환자의 안전을 최우선으로 고려함. 이 제도를 통해 생명에 중대한 영향을 미치는 질환으로, 현재의 승인된 치료법으로는 효과적인 치료가 어려운 환자에게 아직 승인되지 않은 약, 기기, 재생의학 제품의 사용에 따른 위험과 예상되는 치료상의 이점의 균형을 고려하여 예외적으로 사용가능하게 함.
- PMDA 홈페이지에서 주요 치험*과 인도적 관점에서 실시되는 치험(확대 치험)의 정보를 확인할 수 있으며, 매월 말 기준으로 업데이트 됨.
* 주요 치험(主たる治験): 일본 내 신약개발의 마지막 단계인 치험으로, 효능·효과, 용법·용량이 개발 과정을 통해 설정된 후 진행되는 유효성 및 안전성을 확인하기 위한 치험
https://www.pmda.go.jp/review-services/trials/0016.html
- 후생노동성(Ministry of Health, Labour and Welfare, MHLW)은 2024년 11월 25일 「제4회 약사심의회 재생의료 등 제품·생물유래기술분과위원회(第4回 薬事審議会 再生医療等製品・生物由来技術部会」의 개최를 안내함.
v 일시: 2024년 12월 9일(월), 16:00~18:00
v 장소: 웹 회의
v 비공개 안건:
• 심의사항:
- 재생의료 등 제품 'mRNA-3927'의 희귀질병용 재생의료 등 제품 지정 여부
- 재생의료 등 제품 'Avalotcagene ontaparvoec'의 희귀질병용 재생의료 등 제품 지정 여부
- 재생의료 등 제품 'nadofaragene firadenovec'의 희귀질병용 재생의료 등 제품 지정 여부
https://www.mhlw.go.jp/stf/newpage_45769.html
❍ PMDA Updates (2024년 11월호) 게재 (’24.11.28.)
- 의약품의료기기종합기구(Pharmaceuticals and Medical Devices Agency, PMDA)는 PMDA Updates 2024년 11월호를 통해 2024년 10 월 7 일 ‘제12회 일본-대만 의약 교류회의’ 개최 소식을 알림.
- 본 회의는 2013년 11월 5일에 공익 재단법인 교류 협회 및 아동 관계 협회 간에 체결된 "약사 규제 협력 골조에 관한 각서"를 근거로 2013년부터 매년 개최되고 있는 민관 협동의 심포지엄임. 이번 회의는 동아시아 지역에서의 의약품, 의료기기, 재생의료 등 제품의 접근성 향상을 위한 협력체제의 기반 구축의 일환으로 ▲의약품·의료기기·재생의료 등 제품의 규제에 관한 일본·대만의 최신 상황, ▲지속적인 의약품 공급을 향한 대처, ▲일본·대만의 의료보험제도의 최신 정보 등에 관한 강연·의견 교환을 목적으로 개최됨.
https://www.pmda.go.jp/int-activities/outline/0007.html
https://www.pmda.go.jp/files/000272145.pdf
❍ PMDA, 인도적 관점에서 실시되는 치험 정보 업데이트 (’24.11.29.)
- PMDA는 인도적 관점에서 실시되는 치험(확대 치험) 정보를 2024년 11월 29일자로 업데이트함.
- PMDA의 “人道的見地から実施される治験(인도적 관점에서 실시되는 치험)”은 일반적인 임상시험의 기준에 부합하지 않는 환자들에게도 새로운 치료법이나 의약품에 대한 접근을 가능할 수 있도록 도입된 특별한 제도(확대치험)(2016년 1월 22일자 약생심사발 0122 제7호, 2016년 7월 21일자 약생기심사발 0721 제1호)임. 이 제도는 환자의 삶의 질을 향상시키거나 생명을 연장시키는 것을 목표로 일반적 치험의 절차나 기준을 따르진 않으나, 환자의 안전을 최우선으로 고려함. 이 제도를 통해 생명에 중대한 영향을 미치는 질환으로, 현재의 승인된 치료법으로는 효과적인 치료가 어려운 환자에게 아직 승인되지 않은 약, 기기, 재생의학 제품의 사용에 따른 위험과 예상되는 치료상의 이점의 균형을 고려하여 예외적으로 사용가능하게 함.
- PMDA 홈페이지에서 주요 치험*과 인도적 관점에서 실시되는 치험(확대 치험)의 정보를 확인할 수 있으며, 매월 말 기준으로 업데이트 됨.
* 주요 치험(主たる治験): 일본 내 신약개발의 마지막 단계인 치험으로, 효능·효과, 용법·용량이 개발 과정을 통해 설정된 후 진행되는 유효성 및 안전성을 확인하기 위한 치험


